不断创新与突破才是偶联药物未来的破局点。

图片来源:pexels-freestocks.org
文|动脉网
传统的化疗手段除手术外,治疗肿瘤的主要方法通常为铂类药物、烷化剂及紫杉醇类等细胞毒分子。虽然这些化疗药物可有效阻止或减缓恶性肿瘤生长,以至如今仍被广泛作为临床一线治疗方案使用,但是很大一部分化疗药物并不具备靶向识别肿瘤细胞的能力,通常伴有全身毒性,有较大不良反应。
如何在降低副作用的同时提高疗效?偶联药物技术或许是一个解决方式。通过偶联技术,在细胞毒分子基础上,将其与具有肿瘤靶向性的成分偶联,产生一个由多个分子链接在一起的复合物,制成细胞毒分子靶向治疗药物,可有效解决上述问题。
偶联技术的关键在于特定靶向衍生化的蛋白质、DNA、RNA及碳水化合物等新型靶向分子的开发。偶联技术在肿瘤治疗、疾病诊断、高效筛选等方向具有广泛应用,是一个拥有广阔前景的研究领域。
其中,偶联药物是近年来发展的热门领域。说到偶联药物,人们提得最多的是抗体偶联药物(antibody-drug conjugate,ADC)。但除了抗体偶联外,多肽(peptide-drug conjugate,PDC,多肽偶联药物)、核酸适体(aptamer-drug conjugate,ApDC,核酸适体偶联药物)和聚合物(polymer-drug conjugate,聚合物偶联药物)与毒性分子的偶联物在介导药物靶向递送中均有良好且广阔的应用前景。
今天,我们就来详解如今发展如火如荼的ADC,共话冉冉升起的PDC,以及了解和展望其它新兴偶联药物。
说到偶联药物,怎能不说ADC?
这项古老的药物研究技术可以追溯到一百多年前。
1913年,诺贝尔奖得主Paul Ehrlich提出使用抗体靶向治疗疾病的“魔术子弹”(magic bullet)概念。该理论表明,借助这些“子弹”可将药物输送到特定部位,被认为是ADC的最初设想。
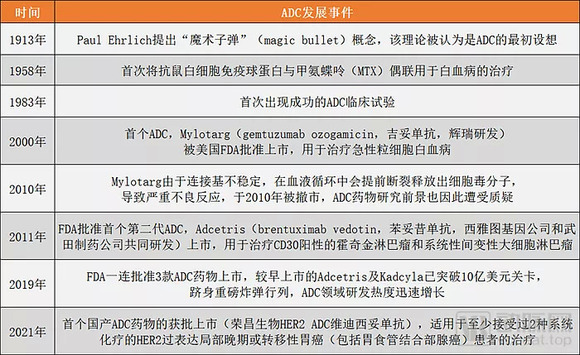
ADC发展历程,根据公开资料整理
发展至今,ADC研究历史已过百年。技术也几经更替,目前为止,ADC研发历程已经到第三发展阶段。
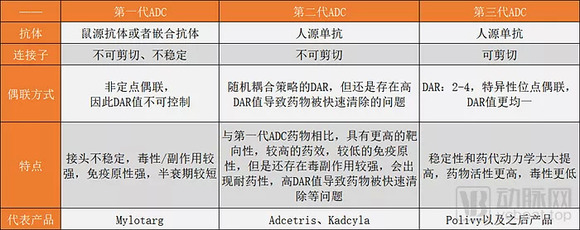
三代ADC发展对比,根据公开资料整理
第一代ADC以辉瑞制药的Mylotarg为代表,具有抗原特异性低、毒/副性强、接头不稳定、半衰期短等缺点;
第二代ADC以Seattle的Adcetris和罗氏制药的Kadcyla为代表。与第一代ADC相比,第二代ADC具有抗原特异性强,药效较高,免疫原性较低等优点,但是还是存在毒副作用较强,耐药性,高DAR(drug-to-antbody ratio,抗体的载药率)值等问题;
第三代ADC通过位点特异性偶联,采用新靶点,可拥有均质单一性ADC,细胞毒性分子更有效,精准度更高、毒性更低。
从ADC历代技术更替中,我们不难看出,ADC药物发展技术与5个要素息息相关。
一是靶点的选择。ADC药物主要应用于肿瘤治疗领域,因此要求抗原靶标能够在肿瘤细胞高表达,在正常组织中低表达或不表达,或仅在特定组织中有表达。此外,还要确保目标抗原存在于细胞表面,以便抗体可识别进入,抗原靶标还应具有一定的内吞能力,触发抗原抗体复合物转运到细胞内。
但肿瘤细胞表面抗原数量有限,抗原抗体复合物的内化过程效率通常较低。所以,靶点的选择具有一定挑战性。
二是抗体的选择。ADC药物中抗体应具备高亲和力和高特异性。早期的ADC使用鼠源抗体或嵌合抗体,免疫原性较强;现在ADC开发均采用人源化抗体或全人源化抗体,亲和力较高。
此外,抗体还应具有低免疫原性、低交叉反应性、适当的连接结合特性、较长半衰期等特征。目前已有的ADC抗体均为IgG分子,该分子对靶点抗原具有高亲和力,在血液中有较长的半衰期。
三是细胞毒素分子的选择。细胞毒素分子是决定ADC杀伤力的关键,除需具有极高的毒性外,还需具有足够的水溶性及血清中的稳定性。目前临床使用的细胞毒素药物根据作用机制可分为微管抑制剂和DNA损伤剂两类。
其中,微管抑制剂主要是奥瑞他汀类衍生物auristatins(如MMAE、MMAF、MMAD)、关登素及关登素类衍生物(如DM1、DM4)等;DNA损伤剂主要是Calichemicin、Duoarmycins、阿霉素类、卡奇霉素等。
四是连接子(Linker)的选择,目前主要分为可裂解连接子和不可裂解连接子。连接子是ADC能否有效递送细胞毒性药物的基础,因此连接子必须在血液循环中保持稳定,在进入肿瘤细胞能够快速释放有效细胞毒药物以杀死癌细胞。
五是偶联方式的选择,主要分为非定点偶联和定点偶联。早期使用的是非定点偶联法,产生的ADC差异极大。定点偶联方式为目前常用,即通过基因工程位点进行特异性偶联,该方式产生的ADC更均一。
除了需考虑上述5个关键因素外,抗体的DAR值问题、药物剂量的确定、体内药动学研究、ADC的组织穿透能力等,也都是需要不断优化的问题。
此外,由于我国ADC药物研发起步较晚,所以存在靶点及适应症研发扎堆的现象。从研发靶点来看,目前我国HER2靶点竞争最为激烈,但也不乏c-Met、EGFR、Trop-2、CD20、BCMA等靶点的药物研发;从适应症来看,与国外ADC药物适应症类似,聚焦于肿瘤领域的药物开发。
总体来看,目前全球已有13个ADC药物获批上市。国内从事相关赛道的企业也已超过40家,包括有荣昌生物、东曜药业、乐普生物、康诺亚、嘉和生物、百奥泰、浙江医药、多禧生物、科伦博泰、交联药物、美雅珂生物、恒瑞医药、豪森药业、百济神州、上海医药、复旦张江、复宏汉霖、普众发现等药企,整体一派欣欣向荣。
从市场体量来看,根据《Nature》预测,2020年以前上市的10款ADC产品到2026年销售总额将超过164亿美元。国内ADC市场在2020年启动,预计2024年及2030年分别达到74亿及292亿人民币的规模,2024年至2030年复合年增长率为25.8%。
从发展趋势来看,根据智慧芽(PatSnap)发布的报告预计,全球ADC药物创新已逐步进入黄金发展期,ADC药物已成为全球创新药企布局的重点方向,未来3-5年可能会迎来新的高峰。
由此看来,不断创新与突破才是这片黄金领域未来的破局点。
相较于目前已经有红海趋势的ADC市场,PDC领域还是一片等待发掘的潜力股之地。与ADC药物相比,PDC药物具有肿瘤穿透性更强、免疫原性较低、生产成本较低、易合成易优化等优点。
PDC的基本组成元素有3个:多肽,细胞素毒物以及连接子。
首先是多肽的选择。近年来随着蛋白质组学、噬菌体展示和多肽固相合成等技术的快速发展,越来越多的新型多肽被发现和被合理设计,极大促进了PDC的发展。
用于PDC的多肽分子一般可分为细胞穿透肽(cell penetrating peptides,CPPs)和细胞靶向肽(cell targeting peptides,CTPs),前者能跨越细胞膜转运药物,后者能特异性地与靶细胞上的受体结合。有文献报道,CPP-药物偶联物可通过转运作用或受体介导的与能量无关的非内吞转运途径进入细胞。
常用CPPs有包括转录反式激活因子(trans-activator of transcription,TAT)、transportan、penetratin 及其衍生物或其它具有穿膜能力的肽。常用CTPs包括精氨酸-甘氨酸-门冬氨酸(RGD)恒定系列肽、黄体生成素释放激素(LHRH)类似肽、通过噬菌体展示技术筛选出来的新型肿瘤靶向肽等。
再是细胞毒药物的选择。用于PDC偶联的细胞毒药物通常是化疗药物,如紫杉醇、DOX、CTP等,它们通过干扰或阻断细胞增殖过程而发挥抗肿瘤作用。但经典的常用化疗药物因选择性不高、对肿瘤靶向能力差,易导致正常细胞和组织的损伤。形成PDC后可提高这些药物对肿瘤组织的靶向性、减少在正常组织中的分布,从而减轻不良反应。
然后是连接子的选择。连接子是连接多肽和药物的有效桥梁,连接子将会影响多肽或药物的功能。与ADC类似,PDC连接子分为不可断裂型和可断裂型。理想连接子应具备低分子、适当长度、合适的稳定性和极性等特征。
基于以上三要素,PDC具备如下优势。
在技术方面,PDC是一种新型偶联药物,它的设计原理部分与ADC类似,主要用于药物递送和肿瘤靶向,不同之处在于ADC中的抗体成分被可作为靶向配体的多肽分子所取代。
也正是由于PDC将抗体换成了多肽,与ADC相比,PDC具有较小的分子量,所以PDC药物有更好的血管、组织和细胞的通透性,易渗透到肿瘤深处,且不会引起免疫原性反应。
此外,PDC药物还能快速被肾脏消除,对骨髓和肝脏的毒性更低;另一方面,与运输药物专用的噬菌体、腺病毒或其他微生物不同,PDC药物的转载不含有传染性物质。
在工艺方面,PDC靠10个氨基酸左右的肽链靶向肿瘤细胞,通过控制肽链的氨基酸序列改变共轭疏水性和电离,这两者都影响着体外和体内的生物利用度。
与抗体生产的复杂工艺过程相比,PDC可利用固相合成法进行大规模制备,PDC的合成与纯化、贮存和质控也都相对容易,体内外稳定性更好,可有效降低大规模生产的成本。
截至目前,全球已有两款PDC药物上市。
2018年1月,诺华子公司Advanced Accelerator Applications S.A的Lutathera获FDA批准上市。Lutathera是全球首款PDC药物,是一款用于治疗生长抑素受体阳性的胃肠胰腺神经内分泌肿瘤肽的受体放射性核素治疗(PRRT)药物。
2021年2月,Oncopeptides公司宣布Pepaxto(melphalan flufenamide,也称为melflufen)获FDA批准上市。melflufen是一款用于治疗多发性骨髓瘤的靶向氨肽酶抗癌PDC药物,可将烷化剂与靶向氨肽酶的多肽偶联在一起。氨肽酶存在于所有人类细胞中,在多种肿瘤中过度表达,包括多发性骨髓瘤。
如今,PDC药物领域已吸引了部分生物医药公司的布局,其中既包括诺华、阿斯利康、罗氏等在内的大型医药公司,也有盛诺基医药、主流生物、同宜医药、泰尔康生物等多家中国公司。
全球来看,PDC药物在适应症方面的选择,主要为重大难治性肿瘤,包括脑瘤、转移性非小细胞肺癌、多发性骨髓瘤、胰腺肿瘤、晚期实体瘤等。国内在研PDC药物的适应症则主要为复发性肿瘤、消化道癌、前列腺癌、肺癌、消化系统癌、乳腺癌等。
总的来说,随着筛选靶向肽或具有靶向功能的穿透肽技术的发展,PDC在技术和应用方面的发展也会更加广阔。期待PDC在ADC发展的盛况下另辟蹊径,壮大偶联药物的荣光。
除了人们较为熟知的ADC、PDC等发展较快、普及较多的偶联药物外,还有一些不为人熟知的偶联药物也在快速发展。
小分子偶联药物(SMDC)、放射性核素偶联药物(RDC)、抗体免疫刺激偶联药物(ISAC)、抗体片段偶联药物(FDC)、抗体片段偶联药物(FDC)、抗体细胞偶联药物(ACC)、病毒样药物偶联物(VDC)、抗体寡核苷酸偶联物(AOC)、抗体生物聚合物偶联物(ABC)、抗体降解偶联药物(ADeC)、前药偶联药物(Pro-DC)、纳米颗粒偶联药物、双环肽偶联药物等数十种偶联药物新技术如雨后春笋般纷纷冒出,在偶联药物这座花园中竞相开放。
以下仅列举几种查阅公开资料整理的偶联药物。
SMDC:尚无产品获批上市但国内企业已有布局
小分子偶联药物(Small molecule-drug conjugates,SMDC)是由小分子的靶向配体与细胞毒药物偶联所得。
与ADC结构部分类似,构成的关键因素有三点:小分子靶向配体、细胞毒分子和连接子。其作用机制也与ADC类似,但SMDC能更快速均匀地分散到肿瘤组织中,且成本低、无免疫原性。
目前SMDC仍未有上市药物,其研发难点主要是小分子配体难以获得,限制了其发展。
2014年,默沙东公司与Endocyte公司合作的SMDC药品vintafolide(长春碱-叶酸偶联物)曾获得有条件上市,但是其Ⅲ期临床试验失败(并未公布具体原因),默沙东与Endocyte从欧盟撤回vintafolide的有条件上市许可申请。
直至今日,SMDC药物研发的历史并不算长,国内外也只有少数几家公司在该领域有所布局,国外代表性公司有Endocyte、Tarveda、Bind Therapeutics,国内仅博瑞生物有公开信息显示布局SMDC药物研发。
RDC:利用核素显像或治疗,有望成为肿瘤诊断新趋势
放射性核素偶联药物(Radionuclide Drug Conjugates,RDC)主要由靶向配体、连接子、螯合物和细胞毒/成像因子(放射性同位素)组成。
RDC与ADC和SMDC的最大差异在于药物载荷。RDC荷载的不再是小分子,而是放射性核素,使用不同的医用核素,可以具备显像或治疗等不同功能,部分核素兼备两种功能。基于这些功能,RDC将有可能成为肿瘤诊断、成像以及治疗的新技术。
目前,国外布局该领域的由诺华、拜耳、加尼福尼亚大学、RadioMedix和Curium等企业或机构;国内的企业,则有远大医药在这一赛道有较多的布局。
ISAC:信达、恒瑞、百济均有布局
2021年8月,信达生物与Bolt(纳斯达克股票代码: BOLT)达成合作,宣布引入Bolt公司的抗体-免疫刺激偶联物(Immune-stimulating Antibody Conjugate ,ISAC)技术,共同开发三款候选药物。
ISAC是一类在功能上与ADC部分类似的偶联药物,它的不同之处在于可以驱动先天免疫和特异性免疫,还可通过TLR激活CD4/CD8 T细胞将冷肿瘤转化为免疫热肿瘤。ISAC通过调节肿瘤的免疫微环境和免疫刺激,达到治疗肿瘤疾病的目的。
目前,国外布局该领域的研发公司有诺华、Bolt Biotherapeutics、Silverback Therapeutics、Mersana Therapeutics;国内除了信达生物通过合作进行研发外,恒瑞医药和百济神州通过自主研发也在积极布局该领域。
不管是近几年声名大噪的ADC,还是初露头角的PDC,或是其它不曾常见的“X-偶联药物”,偶联药物大家族随着技术的发展,展现出了它在重大疾病领域的治疗能力。
未来,也许会出现“万物皆可偶联”的盛况。我们期待偶联药物遍地开花结果,人类疾病治疗得到更优解的未来。