今日看点:格列卫遭遇通用名药竞争。格列卫是诺华公司最畅销的产品,其2014年的全球销售总额达到47.5亿美元,美国市场的销售为22亿美元,占整个美国肿瘤药物市场份额的12.5% 。

1.FDA批准格列卫通用名仿制药,该仿制药有望于明年2月1日在美国上市
日前,美国FDA 批准印度SUN公司的格列卫(Gleevec)通用名仿制药甲磺酸伊马替尼(Imatinib mesylate),并有望于明年2月1日在美国上市。获批剂型为片剂,规格有100mg 和400mg 。因SUN 公司是首家向FDA 提出有关该通用名药物申请的企业,根据美国《Hatch-Waxman法》,SUN 公司将获得为期6个月的市场独占期。
格列卫于2001年获美国FDA批准用于治疗慢性粒细胞性白血病。格列卫是诺华公司最畅销的产品,其2014年的全球销售总额达到47.5亿美元,美国市场的销售为22亿美元,占整个美国肿瘤药物市场份额的12.5% 。目前,格列卫在美国的费用约每月一万美元,每天服用一粒。
此次获批在SUN公司的意料之中。去年诺华公司与SUN公司就对格列卫的专利纷争达成了共识,SUN公司同意将该通用名产品延迟上市7个月,而这7个月为诺华公司带来了近10亿美元的收入。
SUN公司的格列卫通用名药物的上市对诺华公司影响不大,因为诺华公司的另一款针对慢性粒细胞性白血病的药物Tasigna®(尼洛替尼)的全球销售额已达15亿美元,在美国市场的销售额已超5.4亿美元。Tasigna®对那些产生格列卫®(伊马替尼)耐药或者不能耐受的慢性粒细胞白血病(CML)患者疗效显著。
来自Business Standard的一位分析师称,SUN公司格列卫通用名药物在为期6个月独占期内的保守销售额在2.5亿到3亿美元之间。
雷诺陪您读新闻:作为首个分子靶向抗肿瘤药物上市的格列卫对大家而言一定不会陌生。格列卫的问世为靶向分子治疗肿瘤开辟了新时代。迄今为止,全球制药公司正在研发的靶向分子抗肿瘤药物就多达300多种,格列卫的问世从某种意义上还加速了 多种酶靶向抗肿瘤药物在美国的获批。可以说,格列卫在挽救大量CML患者生命的同时也赢得了诸多荣誉。譬如,格列卫曾获《科学》杂志评为2001年世界十大科技突破,其主要研究者先后荣获“欧洲年度发明奖”以及Lasker-DeBakey临床医学研究奖等殊荣。
格列卫已进口中国,进口剂型有片剂(规格:100mg和400mg)和胶囊剂(规格:100mg)。格列卫在中国的零售价为13000元/盒(100mg*60片)。此外,国内已有3家企业江苏豪森、正大天晴和石药集团欧意药业已获得我国CFDA批准的与本品相关制剂的生产批文。
2.FDA批准首个溶酶体酸性脂肪酶缺乏症药物Kanuma®
近日,FDA批准Alexion公司的溶酶体酸性脂肪酶缺乏症(LAL-D)药物Kanuma®。Kanuma®是用于治疗LAL-D的首个获批药物。今年9月,欧盟批准了Kanuma®用于治疗各年龄段的LAL-D的患者。
雷诺陪您读新闻:LAL-D是一种罕见病,主要是因为基因突变而导致的慢性进展性代谢疾病,该基因突变会导致身体各组织器官溶酶体酸脂肪酶活性的显著降低,从而导致胆固醇酯和甘油三酯在肝脏、血管壁和其他组织中慢性的堆积。临床表现主要有肝脾肿大、纤维化、肝硬化和肝功能衰竭。患有该疾病的婴儿、儿童、成人最终因遭受多组织器官损伤而死亡。
3.科学家发明世界首张布洛芬透明贴

布洛芬乳膏是相当有效的止痛药。近日英国 Warwick大学与Medherant公司的研究者研制出世界首款布洛芬透明贴,该透明多聚基膜采用了Bostik公司的粘合技术从而使药物的载药量增加30%,药效是目前透皮贴膏或者凝胶剂的5-10倍。同时,可使布洛芬的止痛药效持续释放达12小时。此外,该透明多聚贴膜不会弄脏衣服,也不易脱落,所以对于那些穿着贴身衣物或经常摩擦的伤口非常合适。严格地说,该款产品对于口服布洛芬剂量不耐受或者有潜在风险的慢性背痛、神经痛以及关节炎等常见疼痛的患者将是一款优越的长效OTC替代产品。
雷诺陪您读新闻:布洛芬是一种非甾体抗炎药,已应用于临床长达40多年。布洛芬因其抗炎、解热和镇痛效果确切,不良反应小,口服易吸收等优点而被广泛应用于不同科室,尤其是对儿科多种疾病具有非常好的治疗或辅助治疗的作用。布洛芬与对乙酰氨基酚和阿司匹林并列为解热镇痛的三大主力军,并已成为全球最畅销的非处方药。此外,布洛芬还是WHO和美国FDA唯一共同推荐的儿童退烧药。
临床试验证实,当体温高于39.2℃时,布洛芬的退热效果优于同剂量的对乙酰氨基酚,且解热时间长。与阿司匹林相比,布洛芬的镇痛作用较阿司匹林强16~32倍,其解热作用与阿司匹林相似但较阿司匹林更持久。布洛芬适用于缓解类风湿关节炎、骨关节炎、脊柱关节炎、痛风性关节炎、风湿性关节炎等各种慢性关节炎的急性发作期或持续性的关节肿痛症状;治疗非关节性的各种软组织风湿性疼痛;治疗急性轻、中度疼痛如手术后、创伤后、劳损后、原发性痛经、牙痛和头痛等;对成人和儿童的发热具有解热作用。
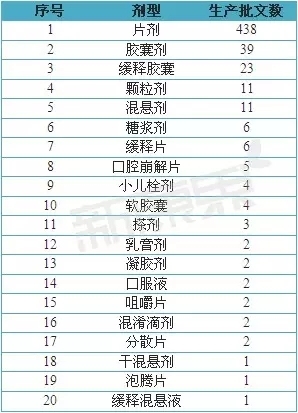
2013年,全球主要非甾体抗炎药市场销售额为251.06亿美元,而布洛芬的市场销售额为34.26亿美元,占全年度市场销售额的13.65%,详细信息见表1。经统计,我国CFDA共批准20种与布洛芬相关的剂型。其中,主要以口服制剂为主,覆盖的剂型有片剂、胶囊剂、颗粒剂等。详细信息见表2。
表1 2013年全球非甾体抗炎药各品种销售情况
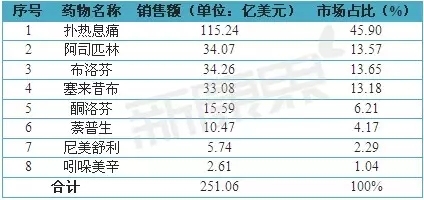
表2 我国布洛芬剂型及批文情况
4.赛诺菲的全球首个登革热疫苗Dengvaxia在墨西哥获批
在经历20年漫长的研发道路以及高达16.5亿美元的研究花费后,赛诺菲的全球首个登革热(Dengue)疫苗在墨西哥获得了批准,墨西哥是Dengvaxia预期上市的20个国家之一。墨西哥药监当局批准Dengvaxia 用于9岁及其以上的人群。Dengvaxia可以预防四种类型的登革热病毒。且对93%的接种人群有效。它可以使登革热感染人群的住院率降低80%。
据分析家预测,2020年Dengvaxia的全球销售额将达14亿美元。另外,赛诺菲预计Dengvaxia将在2016年获得欧盟批准,2017年将在美国获批。
雷诺陪您读新闻:登革热是一种由登革病毒引起的人售共患传染病,广泛流行于热带和亚热带地区,具有传播快、发病率高,对人类危害大的特点。临床特征表现为起病急骤,高热,出血,出疹,淋巴结肿大,全身肌肉和关节痛。登革热由4种不同血清型的登革热病毒引发,各病毒株之间不会产生免疫作用,所以可以被不同的血清型登革病毒重复感染。
登革热威胁着全球近30亿人。据WHO预计,每年有超过1亿人感染登革热。全球每年有50万人(包括儿童)患登革出血热。WHO已设定目标,到2020年,将登革热死亡率降低50%,发病率降低25%。登革热主要流行于非洲、美洲、东地中海、东南亚和西太平洋100多个国家。我国各省均有输入病例报告,广东、云南、福建、浙江和海南等南方省份可发生本地登革热流行。其中,1978年广东发生建国以来首次登革热流行。此后,1980年和1986年在海南省又发生两次大规模的登革热流行。
目前尚无特效的抗病毒药物治疗革登热,主要采用支持及对症治疗措施。
5.武田公司公布Ninlaro®(Ixazomib)治疗复发/或难治性多发性骨髓瘤的Ⅲ期临床结果
日前,武田公司在57届美国血液协会上公布了Ninlaro®(Ixazomib)治疗复发/或难治性多发性骨髓瘤(MM)的Ⅲ期临床结果。在这项名为TOURMALINE-MM1的临床研究中,研究结果显示,与安慰剂+来那度胺(Lenalidomide)+地塞米松(Dexamethasone)相比,每周一次的Ixazomib+来那度胺(Lenalidomide)+地塞米松(Dexamethasone)可有效改善复发/或难治性多发性骨髓瘤患者的疾病非进展期生存期(PFS)。
雷诺陪您读新闻:Ixazomib是美国FDA于2015年11月20日批准的本年度第3个用于治疗MM的药物,上市剂型为口服胶囊剂,规格有2.3mg、3mg和4mg。可以说,Ixazomib是武田公司继其重磅抗肿瘤药物万珂®遭遇专利悬崖之后迅速推出的一款抗肿瘤药物,Ixazomib的获批为武田公司巩固MM药物市场提供了有力保证。值得一提的是,Ixazomib因为一口服制剂,因此其患者依从性优于作为注射剂的万珂®和Kyprolis®。
6.Ⅲ期ENDEAVOR头对头研究结果显示Kyprolis®组合优于Velcade®组合
日前,安进公司公布了Kyprolis® (Carfilzomib,卡非佐米)+地塞米松(Dexamethasone)组合与万珂® (磞替佐米)+地塞米松(Dexamethasone)组合在复发性多发性骨髓瘤患者中进行的名为ENDEAVOR的Ⅲ期头对头的临床研究结果。该临床研究结果显示,Kyprolis®组合组患者的疾病非进展生存期(PFS)为18.7个月,而现有目标治疗方案Velcade®的PFS为9.4个月,两组比较有显著差异。
雷诺陪您读新闻:卡非佐米是一种小分子不可逆蛋白酶抑制剂,最开始由美国Onyx公司开发,2013年安进因以104亿美元收购Onyx而现已成为安进旗下品种。2012年7月20日美国FDA批准卡非佐米用于治疗已使用过包括万珂®(硼替佐米)和免疫调节药物在内的 2 种以上治疗方案,但在 60天内疾病仍有进展的多发性骨髓瘤患者。2015年7月,美国FDA批准卡非佐米+来那度胺+地塞米松的组合疗法用于既往已接受1~3线治疗的复发性多发性骨髓瘤(RMM)患者。上市剂型为注射剂,规格为60mg/瓶。
与万珂®相比,Kyprolis®具有更低的不良反应。然而,与其它MM药物相比,上市后的卡非佐米市场表现并非如意,2014年销售额仅3.3亿美。不过,随着今年新适应症的获批,卡非佐米也由三线用药晋级为二线用药,其市场表现又将如何我们拭目以待。尽管Kyprolis®目前市场表现一般,但这并不会妨碍国内企业对本品的仿制。迄今为止,国内已有江苏豪森、正大天晴和石药集团中奇制药向我国CFDA提出有关本品的注册申请。此外,原研公司也向我国CFDA提出了进口注册。
7.IDF:全世界共有4.15亿成年人患有糖尿病
来自国际糖尿病联盟(IDF)12月1日在“2015年世界糖尿病大会”上最新发布的第7版糖尿病概览(Diabetes Atlas)可知,世界范围内共有4.15亿成年人患有糖尿病,即每11人中便有1人患有糖尿病。自2013年以来,全世界共增加了3100万的成年糖尿病患者。中国和印度的糖尿病人数最多,分别为1.1亿和6900万,太平洋岛托克劳和瑙鲁的成人糖尿病患病率最高,分别为30%和24%。