该研究证实通过新一代单碱基编辑技术有望彻底根治由β-globin珠蛋白突变引发的系列遗传疾病。
文|动脉网
2020年3月17日,国际著名学术期刊《Nature Medicine》在线发表了邦耀生物科学家吴宇轩博士在基因治疗方向的题为“Therapeutic base editing of human hematopoietic stem cells”的研究成果。该研究证实通过新一代单碱基编辑技术有望彻底根治由β-globin珠蛋白突变引发的系列遗传疾病[1]。
来自哈佛大学医学院及波士顿儿童医院Daniel Bauer教授实验室的曾静、华东师范大学吴宇轩研究员、波士顿儿童医院任春妍为共同第一作者。这也是邦耀生物科学家团队近一年来,继发表在《Nature Medicine》、《Cell Research》等期刊的成果后,又一次在基因治疗地中海贫血领域的重大突破。

地中海贫血是全球分布最广、累及人群最多的一种单基因遗传病,根据《中国地中海贫血防治蓝皮书(2015)》的数据显示,目前我国“地贫”基因携带者约3000万人,涉及一亿家庭人口,且中度至重症地贫患者约30万人且正以每年约10%的速度递增。异体造血干细胞移植是目前根治“地贫”的方法,但花费巨大,且配型极其困难,使得基因治疗有望成为新的治疗选择。
β-地中海贫血(β-Thalassemia,地贫)是一种由于β-珠蛋白(β-globin)亚基突变导致患者自身的成人血红蛋白(HbA)异常的遗传性疾病,是全球分布最广、累及人群最多的一种单基因遗传病。其中我国β地中海贫血的检出率为0.67%(约935万)。地中海贫血的重症患者大概有30万,我国的重症地贫患者主要分布在广东、广西、贵州、海南和云南等地。异体造血干细胞移植是根治“地贫”的方法,但花费巨大,且配型极其困难,使得基因治疗有望成为新的治疗选择。
γ-globin是一种胎儿时期表达的珠蛋白,该珠蛋白具有和β-globin相似的功能,编码该蛋白的基因HBG在上述贫血患者中序列完好,但到成年期表达便会被沉默。邦耀科学家团队在先前的研究发现,利用基因编辑技术重新开启胎儿期的γ珠蛋白的表达,代替有缺陷的β珠蛋白,很有可能成为缓解甚至治愈地贫的治疗方法。[2-3]。
2019年3月,邦耀生物科学家吴宇轩博士曾在《Nature Medicine》发文,发现利用基因编辑技术靶向编辑BCL11A红系增强子,会重新开启γ珠蛋白表达,代替有缺陷的β珠蛋白,有望达到根治此类疾病的目的[2]。2020年1月8日,邦耀生物科学家李大力博士又在国际著名学术期刊《Cell Research》发文,通过在造血干细胞中建立超高效的基因编辑技术体系,模拟在部分人群中天然存在的γ珠蛋白启动子突变,可以重新激活胎儿血红蛋白HbF,为β珠蛋白突变引发的系列遗传疾病,提供了安全有效的靶点和方法[3]。
图1. 基于基因编辑技术治疗地贫的策略(来自邦耀生物网站)
单碱基基因编辑技术(base editors,BEs),指能在基因组上引起单个碱基改变的基因编辑技术,可在不形成 DNA 双链断裂的情况下对靶基因位点的单个碱基进行胞嘧啶 C→胸腺嘧啶 T 或腺嘌呤A→鸟嘌呤G 的精准编辑。近年来由于单碱基编辑技术的强大、高效,以及不会产生DNA双链断裂等特点,逐渐成为人们关注的热点,有望在未来的基因治疗中大显身手。因此,利用单碱基治疗β-血红蛋白病(如地中海贫血)将极有可能是一个绝佳的策略。
本研究通过优化的单碱基编辑技术编辑β-地中海贫血和镰刀状贫血患者造血干细胞中的BCL11A增强子位点,或者直接修复发生突变的HBB基因,并进行自体造血干细胞移植,可以使其在体内分化产生具有正常功能血红蛋白的红细胞,从而有可能彻底根治此类疾病。同时也证实单碱基编辑技术在造血干细胞的基因治疗应用中的巨大潜力,为地中海贫血及镰刀状贫血的临床治疗提供了新的解决方案。具体策略如下:
1.优化的单碱基编辑系统,激活胎儿血红蛋白的表达
首先,本研究通过优化的单碱基编辑系统,实现了在人CD34+造血干/祖细胞中的高效基因编辑,然后通过编辑红系特异增强子BCL11A +58位点造成BCL11A在红细胞中表达下调。再将编辑过后的CD34+细胞体外红系分化后,发现BCL11A的表达水平显著降低,同时HbF的含量得到极大提升。
同时还对-28型地中海贫血类型(-28(A/G)是中国地贫人群中常见的突变位点之一)的患者来源CD34+细胞进行了编辑,同时尝试了通过单碱基编辑器同时改变HBB -28和BCL11A +58双位点,结果发现分化后的红细胞更加成熟、体积和形态都恢复至接近于健康细胞水平。
接着,研究人员证实了编辑后的干细胞在移植至小鼠骨髓4个月后仍然保持着极高的编辑效率,且HSC更倾向于C>T编辑,同时能在体内激活红细胞中胎儿血红蛋白的表达。
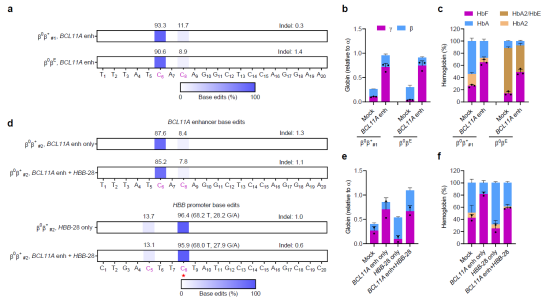
图2. 通过单碱基编辑技术编辑β-地中海贫血患者造血干细胞
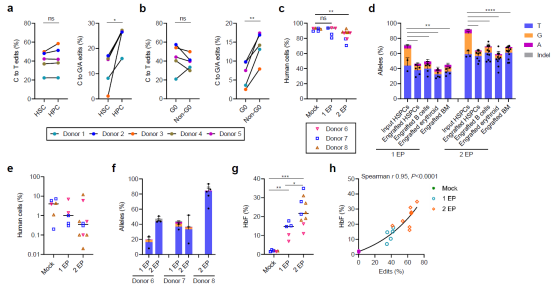
图3. 新一代单碱基编辑工具编辑后的CD34+细胞中可以在小鼠骨髓中长期归巢并保持高效率的C>T碱基编辑
2.SCD患者的细胞编辑后,HbF水平提升且细胞恢复正常形态
最后,研究人员证明了镰刀状贫血病人来源的CD34+细胞也能被高效编辑且在编辑后移植至小鼠体内重建人源血液系统,同时红细胞中HbF的提升水平足以帮助细胞恢复正常形态,抵抗镰刀化。
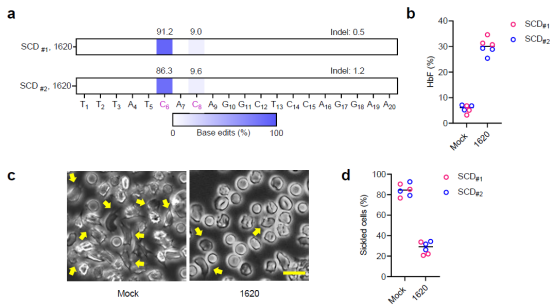
图4.镰刀状贫血患者来源CD34+细胞经单碱基编辑后产生的红细胞可以抵抗镰刀化
据统计,在我国β-地中海贫血的患病率是2.21%,其类型达48种。基因编辑技术介导的基因治疗是精准医学领域的一大突破,利用单碱基编辑技术重新激活胎儿血红蛋白的表达,也为β-地中海贫血的个性化治疗提供了可能性。
目前邦耀生物团队正积极进行科技成果转化,与国内多家顶级医疗单位携手,希望借此项研究及其临床实验的推广,使得基于基因编辑的基因治疗成为我国β-地中海贫血患者全新的临床治疗方案,并有望实现“一次治疗终身治愈”的疗效。
与在基因治疗方面处于领先地位的BlueBird Bio公司的慢病毒疗法LentiGlobin (商品名:Zynteglo,定价高达177万美元,名副其实的成为了全球第二昂贵的药物)相比,邦耀生物采用的治疗方案,更为高效、便捷和安全,且成本极大降低。并且目前国内还没有利用此方法治疗地中海贫血的临床实验,有望成为国内首批进入临床阶段的基因编辑治疗产品。
参考资料:
[1]Zeng J, Wu Y, Ren C, Bauer DE, et al. Therapeutic base editing of human hematopoietic stem cells. Nature Medicine, 2020
[2] Wu Y, Zeng J, Roscoe BP, Liu P, Yao Q, Lazzarrotto CR, Clement MK, Cole MA, Luk K, Baricordi C, Shen AH, Esrick EB, Manis JP, Dorfman DM, Williams DA, Biffi A, Brugnara C, Biasco L, Brendel C, Pinello L, Tsai SQ, Wolfe SA, Bauer DE (2018) Highly efficient therapeutic gene editing of human hematopoietic stem cells. Nature Medicine, 2019
[3] Wang L, Li L, Ma Y, Hu H, et al. Reactivation of γ-globin Expression through Cas9 or Base Editor to Treat β-Hemoglobinopathies. Cell Research, 2020,1